最近在新英格蘭醫學期刊上發表了 AZ第三期報告 ,不意外的數據顯示AZ疫苗具備足夠的保護力以及安全性。
AZ疫苗不是早就在打了嗎?
因為疫情緊張的關係,目前使用的疫苗比如默德納,AZ,BNT原本都是用第三期的期中報告拿緊急授權後就開打,緊急授權是有其時間限制,還是必須完成第三期臨床試驗才能拿到正式授權。
報告內容簡介
這一篇是AZD1222 (也就是目前的AZ疫苗)的pivotal trial (樞紐試驗,新藥研發的過程中以大量患者進行的大規模試驗),採隨機、雙盲及對照設計,在美國、智利、秘魯等88個地點展開。評估疫苗的保護力,安全性,免疫生成性。
研究的設計細節我就不贅述了,直接說重點吧。
研究蒐集了3萬2451位18歲以上志願者 以2:1的比例分配,AZ疫苗組2萬1635人,對照組(安慰劑)1萬816人。
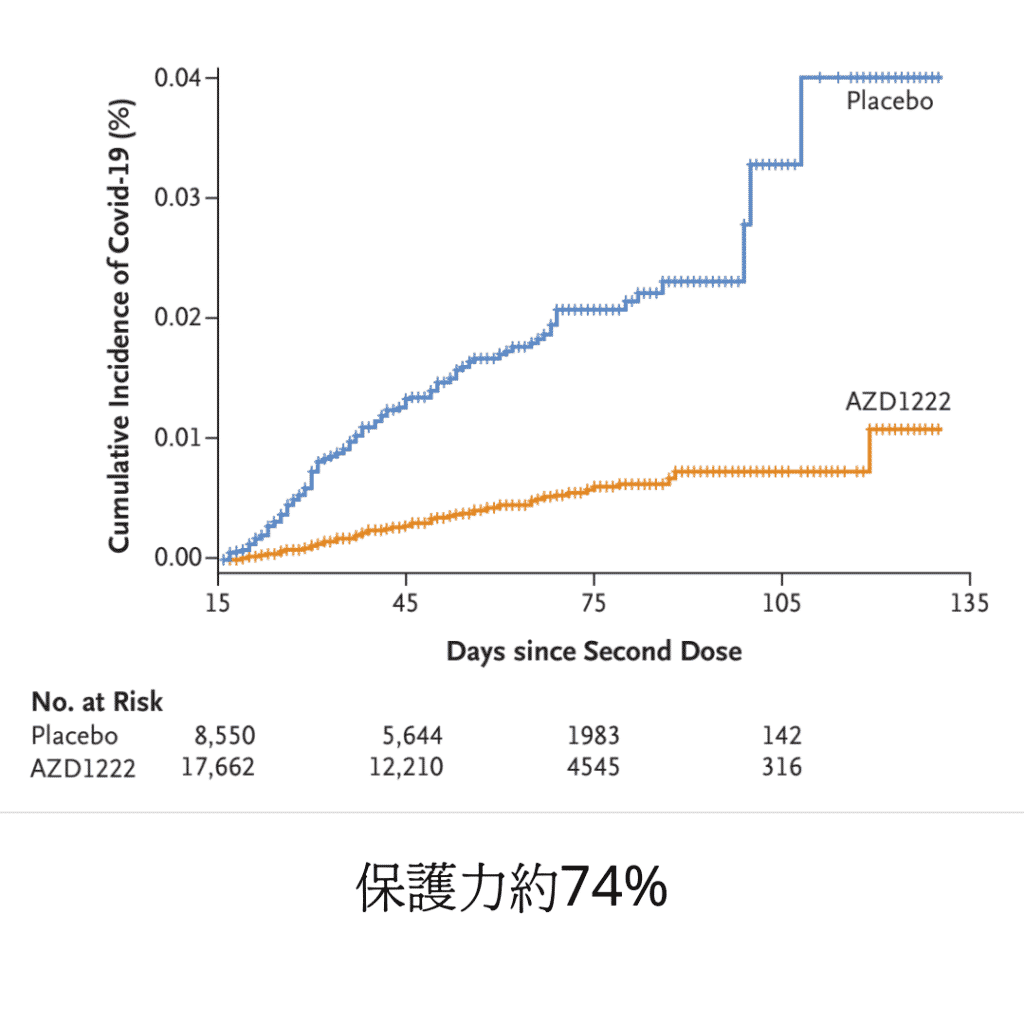
疫苗的保護力(efficacy)74%,年齡大於65歲者,保護力可以到83.5%。疫苗組有症狀感染者203人,重症案例0人;對照組有症狀感染者8550人,新冠重症案例8人。若以住院當觀察點,AZ疫苗的保護力是94.2%。
疫苗的安全性
疫苗組死亡案例7人,對照組也是7人,這些死亡案例最後研判都跟疫苗或者安慰劑無關。
不良反應最常出現的是酸痛,頭痛,注射部位疼痛以及倦怠感。
值得注意的是不論是疫苗組還是對照組,血小板低下血栓的案例數都是0人。
我稍微解釋一下: 發生率極低的不良反應,例如AZ疫苗的血栓的機率大約十萬分之一,在人數三萬左右的第三期臨床試驗很有可能偵測不到,這也是為何疫苗除了臨床試驗之外,正式施打後的安全性追蹤也很重要。
本研究的限制
這個研究中的感染案例變異株數量很少,不足以進行變異株的保護力分析,另外由於研究進行當中,疫苗就正式開打,所以研究被迫提早解盲,是這個試驗的主要限制。
